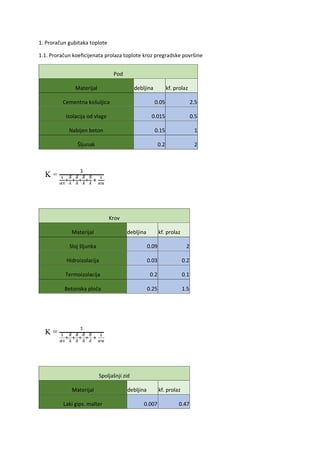
Hromiranje
VISOKA TEHNIČKA ŠKOLA
Novi Beograd
SEMINARSKI RAD
Predmet: Površinska zaštita metala
Tema: PREVLAKE OD HROMA
Profesor:dr. Radivoj Popović Student: Miloš Stjepanović
Br.Indeksa: 10/15
Beograd, 2018
SADRŽAJ
2. Hrom - fizičko-hemijske karakteristike...........................................3
2.1 Industrijska primena hroma........................................................5
3. Galvanotehnika................................................................................ 6
4. Priprema uzoraka za nanošenje metalne prevlake...........................9
4.1 Odmašćivanje...........................................................................10
4.2 Hemijska primena....................................................................11
4.3 Elektrohemijska priprema........................................................11
5. Hromiranje.....................................................................................12
5.1 Vrste hromiranih prevlaka........................................................12
6. Zaštita i održavanje hromnih prevlaka..........................................13
2

2. Hrom - fizičko-hemijske karakteristike
Prelazni hemijski elemenat hrom je igrao važnu ulogu u razvoju neorganske i
koordinacione hemije. Prvi poznati mineral hroma (lat. chromium) je 1766. godine
otkrio francuski hemičar Leman i nazvao ga je sibirskim crvenim olovom. Danas se
ovaj retki mineral naziva krokoit (olovo-hromat, PbCrO4). Tridesetak godina kasnije,
1797. Volken (Louis Nicolas Vauquelin) je izdvojio iz njega čisti metal, a njegovi
saradnici su ga nazvali hromom, prema grčkoj reči chroma – χρωμα, što znači boja, s
obzirom na to da su hromova jedinjenja uglavnom obojena. Tako se pronalazačem
hroma smatra Volken, mada je oko toga bilo dosta polemike. Hrom je metal
srebrnasto-bele boje sa plavkastom nijansom koja se može polirati do visokog sjaja.
Hrom poseduje prostorno centriranu kubnu kristalnu rešetku. Spada u teško topljive
metale (Temperatura topljenja=18600 ° C) i ovako visoka temperatura topljena
posledica je postojanja veoma jake hemijske veze u njegovoj kristalnoj rešetki koja se
ostvaruje preko velikog broja valentnih elektrona (selektrona iz poslednjeg i d-
elektrona iz predposlednjeg nivoa). Spada u teške metale (gustina = 7.2g/m3 ) velike
tvrdoće. Po mestu nalaženja hrom je litofilni elemenat i u litosferi je prisutan u sastavu
različitih mineral. Sadržaj hroma u litosferi je 3.10 –2% mas. Njegov najznačajniji
mineral je hromit – FeO.Cr2O3. Pored njega hrom se javlja i u obliku minerala
uvarovita Ca3Cr2(SiO4)3 i krokita PbCrO4. Ima ga i u vodama u prirodi (morska voda
sadrzi 3.10-4 % mas hroma) i u živim organizmima. [9], [10]
Slika 1. Kristali hroma pored kocke metalnog hroma od 1cm3
Elektronska konfiguracija atoma hroma je: Cr 1s2 2s2 2p6 3s2 3p6 3d5 4s1 . Ona
pokazuje da hrom ima 6 valentnih elektrona (5d i 1 s-elektron) zbog čega je njegov
maksimalan oksidacioni broj +6. Angažovanjem manjeg broja valentnih elektrona za
ostvarivanje hemijske veze, hrom gradi jedinjenja sa oksidacionim brojevima
+2,+3,+4 i +5. Značajna jedinjenja hroma su sa oksidacionim brojem +2,+3 i +6 a
najstabilnija jedinjenja su sa oksidacionim brojem +3. Na sobnoj temperaturi hrom je
4
dosta inertan što je posledica stvaranja kompaktne oksidne opne na njegovoj površini.
Zbog postojanja ove opne hrom je na običnoj temperaturi postojan na dejstvo i vode i
vazduha. Pri zagrevanju njegova reaktivnost raste i on reaguje sa mnogim
supstancama. Sa halogenim elementima daje halogenide raz ličitog sastava (CrF2,
CrCl2, CrJ2, CrCl3 itd.). Na povišenoj temperaturi reaguje sa kiseonikom dajući
hrom(III)-oksid - Cr2O3, koji je amfoteran i u vodi nerastvoran. Indirektnim putem
daje i druge okside: hrom(II)-oksid –CrO koji spada u bazne i u vodi nerastvorne
okside, kao i hrom(VI)-oksid –CrO3 koji spada u kisele i u vodi rastvorne okside.
Reakcijom soli hroma i baze dobijaju se hidroksidi hroma: hrom(II)- hidroksid -
Cr(OH)2 koji je baznih, i hrom (III)-hidroksid - Cr(OH)3 koji je amfoternih
karakteristika ( rastvara se u kiselinama i u bazama).
Pri alkalnom topljenju (reakcijom u čvrstoj fazi ) nastaju soli metahromaste kiseline –
metahromiti za koje je uobičajeno da se nazivaju hromiti:
Cr(OH)3+NaOH→NaCrO2+2H2O (natrijum-hromit)
Na povišenoj temperaturi hrom reaguje sa sumporom dajući sulfide, fosforom dajući
fosfide, sa azotom dajući nitride, sa ugljenikom dajući karbide i nastala jedinjena su
promenljivog sastava (Cr3P, CrP, CrN, Cr2N, Cr2C, CrS, Cr2S3 itd.).
Rastvara se polako, na običnoj temperaturi, u razblaženim rastvorima kiselina čiji
anjoni nemaju oksidaciona svojstva :
Cr +2HCl→CrCl2+H2 i Cr+H2SO4→CrSO4+H2
Brzina rastvaranja hroma u ovim kiselinama raste na povišenoj temperaturi. Hrom se
ne rastvara u azotnoj kiselini zbog stvaranja sloja kompaktnog i u vodi nerastvornog
oksida na njegovoj površini. Zbog toga se hrom koristi kao prevlaka na drugim
metalima da bi se oni zaštitili od korozije a i da bi dobili dekorativni izgled
(hromiranje). U oksidacionom stanju +6 hrom ulazi i u sastav kiselina hroma i
njihovih soli. Kiseline hroma sa ovim oksidacionim stanjem nastaju rastvaranjem
kiselog oksida CrO3 u vodi i njihov se sastav može prikazati opštom formulom H2Cr
nO3n+1 (n= 1, 2, 3 i 4). Najznačajnije kiseline hroma su: hromna-H2CrO4, u kojoj je
n=1 (jaka dvoprotonska kiselina) koja daje soli hromate i hidrogenhromate i dihromna-
H2Cr2O7 (još jača dvoprotonska kiselina) u kojoj je n=2 i koja daje
hidrogendihromate.
Većina hromata je nerastvorna u vodi (izuzetak su hromati alkalnih metala) i zato ih
ima ulitosferi. U čvrstom stanju hromati su žute boje. Vodeni rastvori rastvorljivih
hromata su
5
Želiš da pročitaš svih 16 strana?
Prijavi se i preuzmi ceo dokument.
Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.
Slični dokumenti

Prikazano 4 od 60 rezultata